Il y a trois mois j’ai trouvé un pigeon biset (Columba livia) mort devant ma porte. Je l’ai récupéré et mes précieux petits insectes se sont chargés de le nettoyer pour moi. Je l’ai ensuite nettoyé avec une brosse à dent, de l’eau chaude et un peu de liquide vaisselle puis je l’ai placé 24h dans un bain de peroxyde d’hydrogène pour le blanchir et le désinfecter.
Je n’ai pas énormément de choses à dire sur ce squelette, ci ce n’est qu’il s’agit d’un immature. En tombant au sol il s’est brisé le coracoïde et l’ulna droit. J’ai encore réussi à perdre cinq phalanges durant le processus de nettoyage. Le crâne et la mandibule étaient en différents morceaux que j’ai donc recollés. Malheureusement j’ai fait une erreur au niveau des maxillaires, mais avec la superglue, impossible de faire machine arrière.
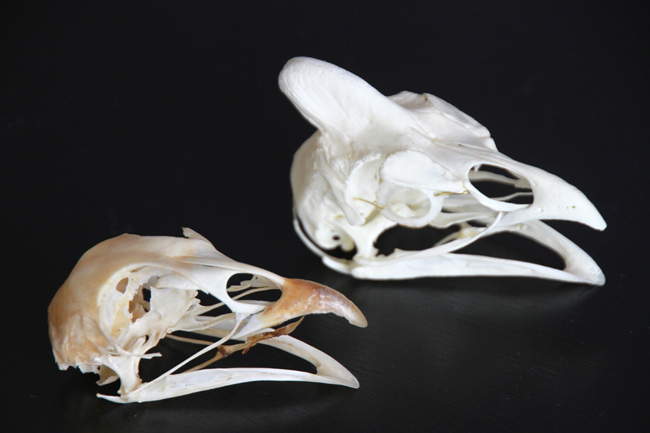
Ce que j’ai trouvé intéressant avec ce squelette, c’est la comparaison avec celui du jeune pigeon ramier (Columba palumbus). Il s’agit d’un oiseau plus grand et massif au niveau morphologique. La comparaison montre que les ceintures scapulaire et pelvienne sont plus développées chez le pigeon ramier, les os des membres supérieurs sont plus grands mais avec les mêmes proportions, les crânes ont la même taille, et par contre les os des membres postérieurs (sauf les fémurs) sont plus petits.
J’ai également trouvé des graines dans son estomac, qui montrent son dernier repas.


Après le passage des larves de mouche et de dermeste.

Le crâne et les graines.

Durant le bain de peroxyde d’hydrogène.

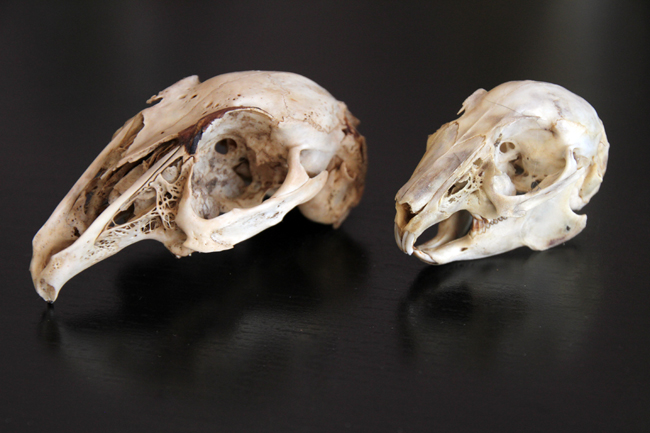
Le remontage du crâne à gauche. Celui de droite correspond au pigeon ramier.

Comparaison entre le crâne de pigeon ramier (gauche) et celui du pigeon biset (droite).
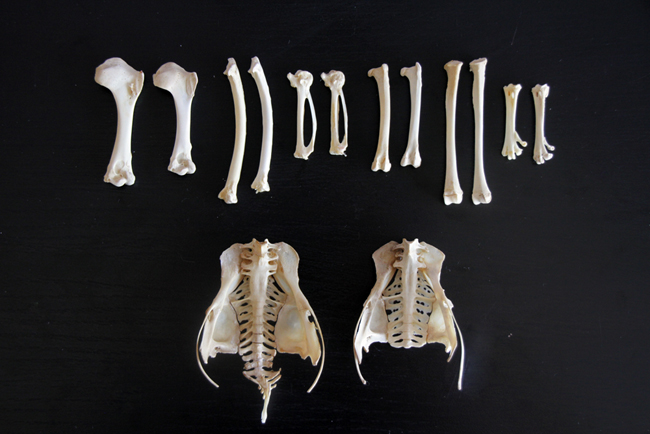
Comparaison entre des os de pigeon ramier (gauche) et de pigeon biset (droite).